ラーニングコーナー
2019/06/24
幹細胞におけるCRISPR-Cas9ゲノム編集、および脳オルガノイドの形成
- 用途別細胞培養
ヒト多能性幹細胞(human pluripotent stem cells: hPSCs)を用いたヒト疾患のモデリングは、CRISPR-Cas9によるゲノム編集と組み合わせることで、病理メカニズムの研究における重要な戦略となってきています。
本ページでは、Dr. Lancasterらの大脳オルガノイド研究の成果(Lancaster et al, Nature 2013)にもとづき、小頭症疾患モデルの作製に成功した研究例をご紹介しています。STEMCELL Technologies社の研究グループは、ArciTect CRISPR-Cas9 systemを使用して、原発性小頭症の発症に関与する遺伝子であるCDK5 regulatory subunit-associated protein 2 (CDK5RAP2) のC末端欠失型を有するクローンを作製しました。安定なクローンについて、さらに細胞品質特性(核型、多能性、形態、およびマーカーの発現)の特徴づけを行い、STEMdiff Cerebral Organoid Kit(ST-08570)で大脳オルガノイドへと分化させました。
出典:Leon H. Chew et al., EMBL Organoids 2018
オルガノイド疾患モデル 研究の概要
- hPSCのゲノム編集、細胞品質チェック、および遺伝子編集済みの安定クローン株作製について、ワークフローを確立しました。
- CDK5RAP2のトランケーション(切断)は、有糸分裂の際、通常は紡錘体に局在するCDK5RAP2に誤った局在化を引き起こしました。
- CDK5RAP2がC末端欠失型になっているクローンは、対照群に比べて小さい大脳オルガノイドを生成し、Lancasterら* のデータに類似した神経マーカーの発現上昇と神経前駆細胞マーカーの発現低下がみられました。
* Lancaster MA, Renner M, Martin CA, Wenzel D, Bicknell LS, Hurles ME, Homfray T, Penninger JM, Jackson AP, Knoblich JA. Cerebral organoids model human brain development and microcephaly. Nature. 2013 Sep 19;501(7467):373-9.
実験方法
実験結果
ArciTect CRISPR-Cas9ゲノム編集による、CDK5RAP2での停止コドン
遺伝子編集したCDK5RAP2クローンに対する遺伝的な安定性の確認
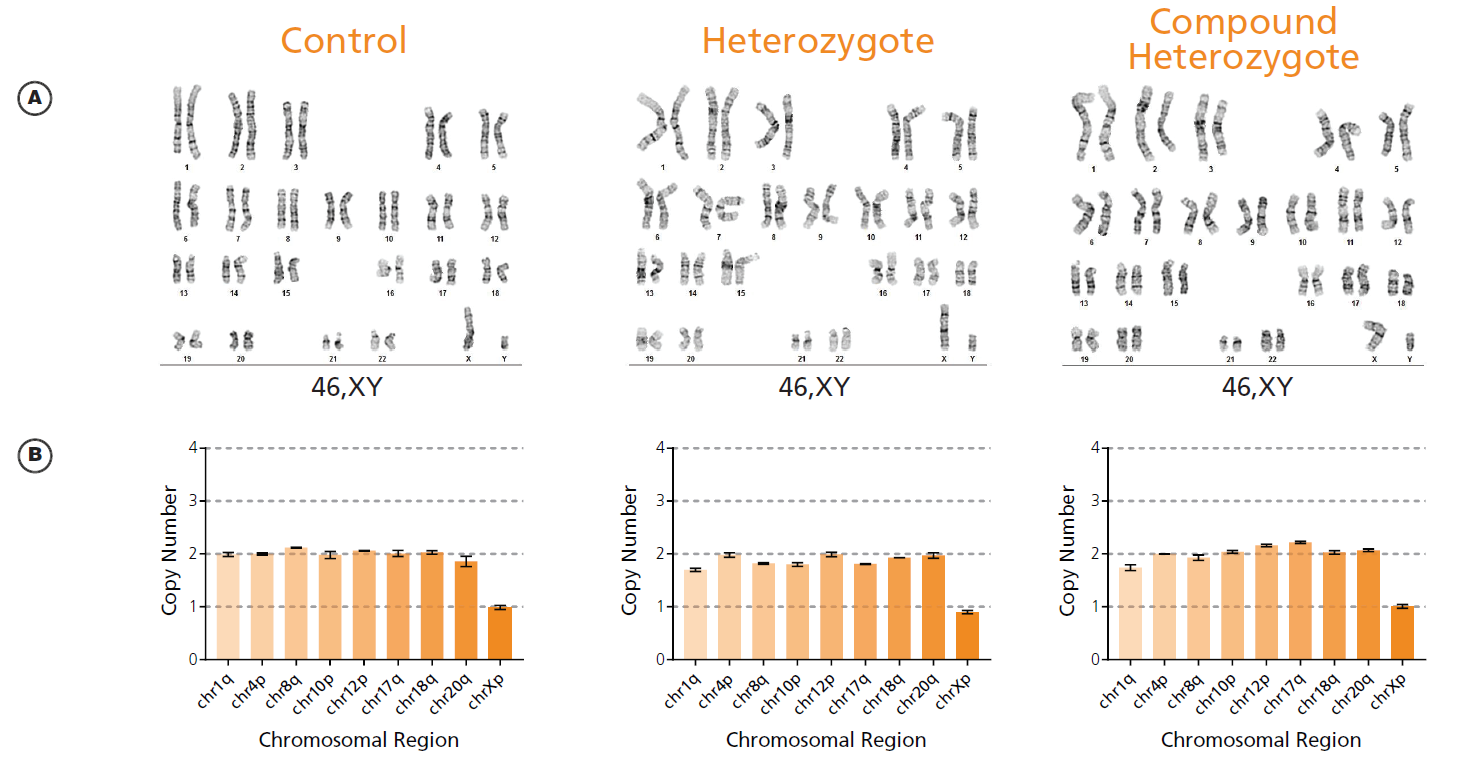
A)5回目の継代において、コントロールと遺伝子編集された細胞株の核型は正常な二倍体を示しています。倍数性は、hPSCの典型的なバックグラウンドレベル(<10%)と比較して、ヘテロ、複合ヘテロ両細胞株で上昇がみられます(ヘテロ:~20%、複合ヘテロ:~33%)。これは、分裂中期や細胞質分裂の際の染色体分離で潜在的なエラーが起こっている可能性を示しています。
B)遺伝子編集された細胞株を、9個の遺伝子座における再発性の核型異常についてスクリーニングしました。スクリーニングされた細胞株はすべて、p5、p10においては正常な倍数体コピー数を示していました。
複合ヘテロクローンでは細胞分裂の間CDK5RAP2が誤った局在となるが、hPSCの増殖率には影響なし
CDK5RAP2は大脳オルガノイドのサイズを減少させ、Day18でマーカー発現に影響を与える
関連ウェビナー紹介
小頭症モデルのための、大脳オルガノイドのCRISPR-Cas9遺伝子編集
CRISPR-Cas9 Gene Editing of Cerebral Organoids to Model Microcephaly
演者
Dr. Leon Chew (Scientist, STEMCELL Technologies社)
内容
小頭症をモデル化するため大脳オルガノイドのゲノム編集を行った研究についての、バーチャルポスター発表です。CRISPR-Cas9を使用して変異hPSC株を作製し、安定したクローンの細胞品質特性を明らかにし、大脳オルガノイドに分化させた方法を説明します。得られた大脳オルガノイドはLancaster博士の報告より小さい一方で、神経発生に同様の欠陥を持っていました。(収録時間10分8秒、2019/2公開)
関連情報
「STEMdiff Cerebral Organoid」パフォーマンス vs. 適さない試薬
iPS細胞を用いた大脳オルガノイドの解析にベリタス取扱製品を使用 研究者の声【11】
腸・大脳・肝臓・膵臓・肺・腎臓オルガノイド研究用培地(STEMCELL Technologies社)
「mTeSR Plus」新発売:週2回の培地交換で高品質なES/iPS細胞を!
「mTeSR1」フィーダー細胞が不要なヒトES/iPS細胞維持用 無血清培地