ラーニングコーナー
2024/04/22
適正・最良なキメリズム解析のために(国内外ガイドラインの紹介)
- 移植・HLA・MHC
キメリズム検査でレシピエントドナーの細胞割合を経時的に観察することで、生着の状態や再発、腫瘍細胞の有無をモニタリングすることができます。現在増加しているさい帯血移植の場合、生着までの期間が長く生着不全となる割合が高いと言われており、キメリズム検査によるモニタリングが必要となります。また、HLA半合致移植(ハプロ移植)の場合、移植後に発生する移植片対宿主病(GVHD)のリスクが高くなります。このような移植成績に関連する情報も得ることができるため、キメリズム検査は移植医療において非常に重要な検査となります。
適正かつ最良なキメリズム解析を実施するためには、手法や記録、精度管理の基準を設定することが必要と考えられます。
本ページではキメリズム解析に関する国内外でのガイドラインや、解析の実施状況について紹介します。
国内でのキメリズム解析に関するガイドライン
国内では、キメリズム解析に関して検体の条件や記録の形式を規定するような、一般的なガイドラインは策定されていないのが現状です。
精度管理についても、各施設の基準において内部精度管理や外部精度管理を実施していると思われます。また、ISOやCAP (The College of American Pathologists)の認証を受けている施設では、条件に応じた精度管理を実施していると考えられます。
海外でのキメリズム解析に関するガイドライン
ASHI(アメリカ組織適合性学会)ではキメリズム解析に関するガイドラインが記載されています。
- D.5.3.4.1 Laboratories performing chimerism testing must:
(キメリズム検査を実施する検査施設は、以下の条件を満たさなければならない:) - D.5.3.4.1.1 Have reagents or testing mechanisms appropriate to identify informative recipient and donor markers among individuals tested, except monozygotic twins.
(一卵性双生児を除き、検査された個体間で、レシピエントマーカーとドナーマ ーカーを同定するのに適切な試薬または検査機構を有する。) - D.5.3.4.1.5 Include appropriate controls for the characteristic used (e.g., size, sequence polymorphism) to distinguish donor and recipient alleles in each test.
(各検査において、ドナーとレシピエントの対立遺伝子を区別するために使用される特性(例えば、サイズ、配列多型)に関する適切なコントロールを含むこと。) - D.5.3.4.1.7 Establish criteria for evaluating the relative amounts of recipient and donor in a mixed chimeric sample if results are reported in a quantitative or semi-quantitative manner.
(結果を定量的又は半定量的に報告する場合、混合キメラ試料中のレシピエント及びドナーの相対量を評価するための基準を定めること。) - D.5.3.4.1.8 Document the purity obtained if processing involves isolation of cell subsets. If purity is not assessed, document on the test report.
(細胞分離処理が含まれる場合は、得られた純度を文書化する。純度が評価されない場合は、試験報告書に記載する。)
一方、EFI(ヨーロッパ組織適合性学会)でも同様のガイドラインが作成されています。
- E4.11.3 The sensitivity of the HCE assay must be validated using DNA mixtures from two individuals at defined ratios/concentrations, before implementation into clinical use
(HCE:Haemopoietic Chimaerism and Engraftmentアッセイの感度は、臨床応用の前に、評価された比率/濃度の2人の個人からのDNA混合物を用いて検証されなければならない。) - EE4.11.5 Donor and patient specific allele profiles must be:
E4.11.5.1 Determined using appropriate reference material
E4.11.5.2 Documented
(ドナーおよび患者のアレル情報は適切な標準物質を用いて決定されなければならず、また記録されていなければならない) - E4.11.9 When HCE testing is performed on cellular subsets isolated by cell sorting, the purity of the sorted population:
E4.11.9.1 Must be documented and
E4.11.9.2 Taken into account in the analysis of the results
(細胞分離された細胞サブセットに対してHCE試験を実施する場合、選別した集団の純度は文書化されなければならず、かつ結果の分析において考慮されなければならない。) - E4.11.12 In addition to the requirements from standard F3.5.7, the report must contain
E4.11.12.1 A description of the specimen used for testing (bone marrow, peripheral blood, cellular subsets isolated by cell sorting etc.)
E4.11.12.2 The date of transplant
E4.11.12.3 Other information if deemed relevant for HCE interpretation (i.e. limited informative markers or clinical condition of the patient)
(レポートには検査に使った検体の情報(~中略~)、移植日、HCEの解釈に関連すると思われるその他の情報を含めなければならない)
EFI Standards for Histocompatibility & Immunogenetics Testingより抜粋
国内外におけるキメリズム解析の実施状況
国内でのキメリズム解析の実施状況
国内のキメリズム解析の状況について広く調査された報告は把握できておりませんが、国内の受託検査施設の情報や各種発表文献から推測すると、多くの施設でSTR-PCR法を採用していると考えられます。
しかし近年ではqPCR法を使用したキメリズム解析を検討した結果が報告されています(Minakawa et al., 2022)。
海外でのキメリズム解析の実施状況
2019年にASHI/EFI認定施設を対象に行ったアンケート調査の結果が論文として発表されています(Blouin et al., 2021)。調査した施設のうち、56%にあたる54施設からの回答を抜粋して紹介します。
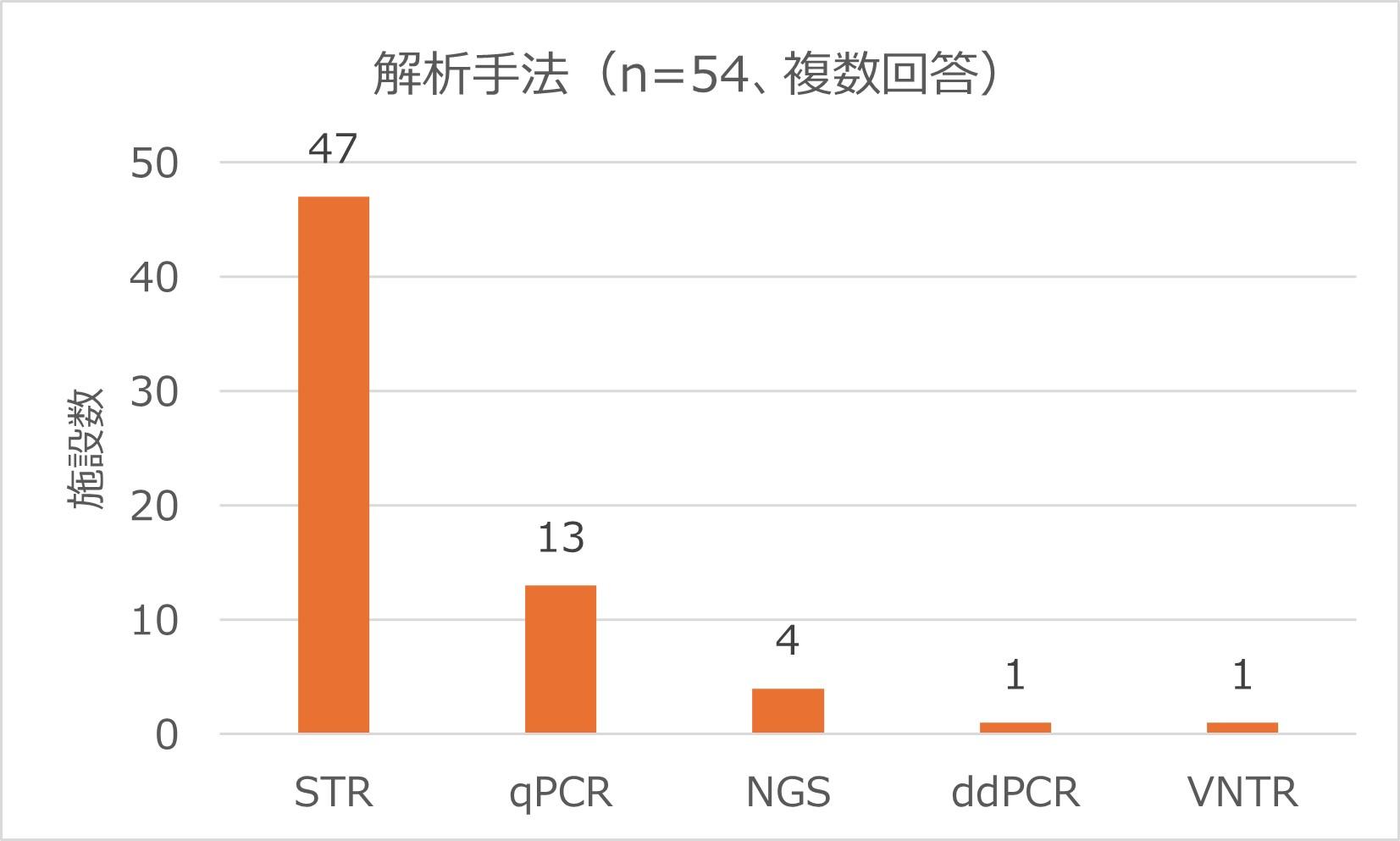
手法について
87%(47施設)の施設がSTR法を採用していました。STR法以外の手法を組み合わせて採用している施設もありました。また、qPCR法が24%(13施設)、NGS法が7%(4施設)、ddPCRが2%(1施設)となっていました。
検体について
ほぼすべての施設が末梢血と骨髄液両方を検体として使用していました。とくに89%(47施設)ではおもに末梢血が使用されています。
精度管理について
77%の施設が外部精度管理を実施しており、品質管理を定期的に実施していることが示唆されました。ASHIのProficiency Testプログラムを利用している施設が14施設と最も多く、次いでUK NEQAS(External Quality Assessment Services)、CAP、EFIなどがありました。
ベリタスが提供するキメリズム解析関連商品
EasySep(STEMCELL Technologies社)を使ったlineage specificキメリズム解析
EasySepはカラムを必要としない免疫磁気細胞分離試薬です。全血や骨髄血などのキメリズム解析用の検体からわずか15分で目的の細胞をポジティブ分離することが可能です。分離した細胞はフローサイトメトリーやDNA解析に直接用いることができ、特定の細胞種に着目したキメリズム解析(lineage specificキメリズム解析)を行えます。
EasySepはキメリズム解析の対象とする細胞種やスタート時の検体の違いにより、最適な試薬が提供されています。
|
細胞種 |
対象マーカー |
スタートサンプル |
|
|
全血、バフィーコート |
単核細胞(全血、骨髄液由来) |
||
|
T細胞 |
CD3 |
||
|
B細胞 |
CD19 |
||
|
CD19/CD20 |
- |
||
|
骨髄系細胞 |
CD15 |
||
|
CD33 |
|||
|
CD33/66b |
- |
||
|
顆粒球 |
CD66b |
- |
|
|
単球 |
CD14 |
||
|
NK細胞 |
CD56 |
||
|
造血幹細胞 |
CD34 |
||
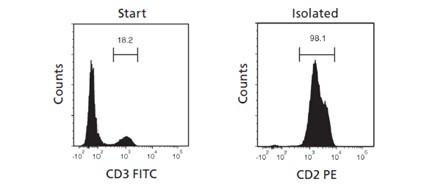
細胞分離による特定細胞の濃縮例
全血からEasySep™ HLA Whole Blood CD3+ Positive Selection Kit(ST-17871)を使用してCD3陽性T細胞を分離しました。T細胞の割合が分離前の18.2%から98.1%に増加しました。
EasySep試薬を活用したキメリズム解析のご紹介(研究者の声)
EasySep試薬を使用し、異なる種類の検体(末梢血・骨髄血)から同じワークフロー、かつ高精度のキメリズム解析を実施可能なプロトコルを確立した、国内の先生の研究をご紹介しています。
同種造血幹細胞移植後 CD34+ キメリズム解析の検討 研究者の声【42】
Devyser Chimerim NGS(Devyser Diagnostic AB社)を使った高感度キメリズム解析
Devyser Chimerim NGSは、次世代シーケンサー(NGS)使ったキメリズム解析試薬です。造血幹細胞移植のスクリーニング検査(ドナーおよびレシピエントに存在するユニークな遺伝子マーカーを同定)、モニタリング検査(移植後レシピエントに存在するドナー細胞の割合を測定)両方を高感度に測定することが可能です。
- NGS(Illumina社の次世代シーケンサー)を利用したシンプルかつ簡単な試薬:ハンズオン45分、2日以内に結果取得
- 1ウェルで検体中の24マーカーを増幅
- スクリーニング検査、モニタリング検査の両方を同じプロトコルで実施可能
- 高い検出感度と精度:検出限界(LOD95/LOQ95)0.05%、検出範囲0.05~100%
- 専用ソフトウェアで迅速な解析
Devyser Chimerism NGS製品ページはこちら
Devyser Chimerism NGSでマイクロキメリズムを検出した例
臨床検体を含む422検体をDevyser Chimerism NGSを使って解析したところ、LODが0.1%となったことが示されました。また移植後再発を来たした6症例では、NGS法を使用することによりSTR法でキメリズムを検出できた時期よりもさらに早い段階(1%以下)のマイクロキメリズムを検出することができています。
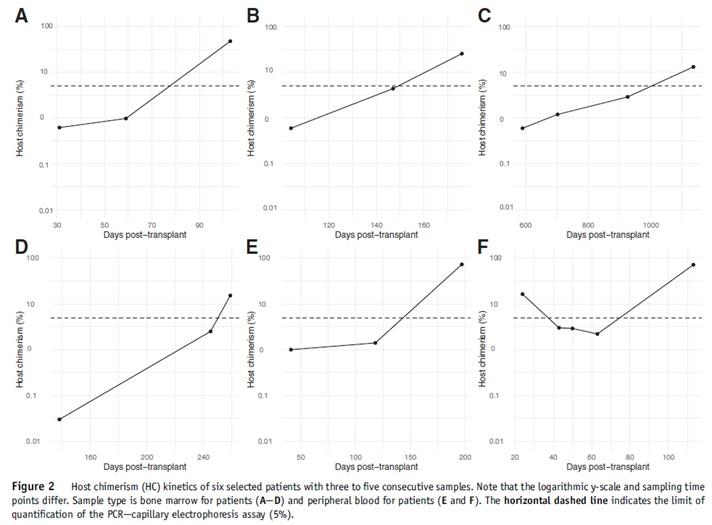
(Lindahl et al., Bone Marrow Transplant., 2022)
また、下記の報告では急性骨髄性白血病(AML)において、細胞分離によってCD33陽性細胞(骨髄系細胞)を濃縮した後、Devyser Chimerism NGSを使用したキメリズム解析を行っています。
移植後60日以内のレシピエントDNAの割合が0.2%未満となった患者は、0.2%を超えた患者に比べて再発割合が低いことが示されています。
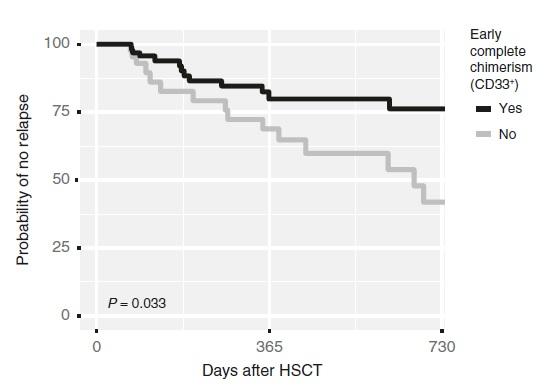
(Vynck et al., J Mol Diagn., 2021)
関連製品
-

Devyser Chimerism NGS
-
EasySep HLA Chimerism Whole Blood Lymphoid Positive Selection Kit
-
EasySep HLA Chimerism WB CD8 Positive Selection Kit
-
EasySep HLA Chimerism WB CD4 Positive Selection Kit
-
EasySep HLA Chimerism WB B Cell Positive Selection Kit
-
EasySep HLA Chimerism Whole Blood CD66b Positive Selection Kit
-

EasySep HLA Chimerism Buffy Coat CD14 Positive Selection Kit
-
EasySep HLA Chimerism Whole Blood CD33 Positive Selection Kit
-
EasySep HLA Chimerism Whole Blood CD15 Positive Selection Kit
-
EasySep HLA Chimerism Whole Blood Myeloid Positive Selection Kit
-
EasySep HLA Chimerism Whole Blood CD3 Positive Selection Kit
-
EasySep HLA Chimerism Whole Blood CD19 Positive Selection Kit
-
EasySep HLA Chimerism Buffy Coat CD56 Positive Selection Kit
